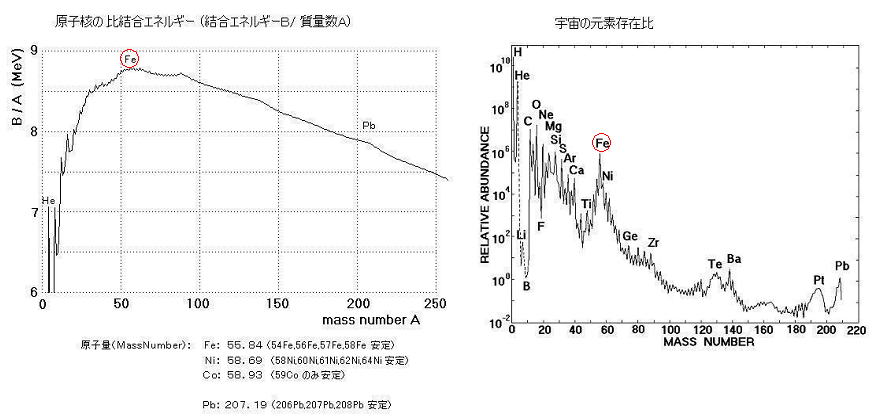
丂丂丂丂丂丂丂丂丂丂丂傾儖僇儕嬥懏偺幚尡
丂丂乮侾乯丂僫僩儕僂儉偲偦偺壔崌暔丗
丂丂嘆丂嬥懏僫僩儕僂儉偺幚尡丗 婋尟丒庢傝埖偄梫拲堄両丂丂嬥懏偺僫僩儕僂儉乮塸岅偱Sodium丄梈揰丗97丏7亷丄暒揰丗883亷丄斾廳丗侽丏俋俈丄僋儔乕僋悢俀丏俇俁亾乯偼丄戙昞揑側傾儖僇儕嬥懏偱丄揹婥堿惈搙乮侽丏俋俁丄芜柏莞迊j偑掅偔丄巁慺丄悈丄僴儘僎儞丄傾儖僐乕儖側偳偲寖偟偔斀墳偡傞丅 岺嬈揑偵偼怘墫偲墫壔僇儕僂儉乮梈揰傪壓偘傞乯偺崿崌暔傪梟梈揹夝偟偰惢憿偝傟傞丅
丂丂幚尡幒揑偵娙扨偵嶌傞曽朄偼側偄偑丄扽慺朹揹嬌偵傛傞梟梈墫揹夝偱偼丄堿嬌偵僫僩儕僂儉偑惗惉偡傞偲摨帪偵擱從偡傞偺偑尒傜傟傞丅 傑偨丄怘墫悈偺悈嬧堿嬌偵傛傞揹夝偱偼丄僫僩儕僂儉傾儅儖僈儉偑惗偠偰丄斾妑揑埨掕偵悈嬧偲偺崌嬥傪嶌傞偙偲偑偱偒傞丅乮嬥懏僫僩儕僂儉偦偺傕偺偼悈嬧偲愙怗偝偣傞偲寖偟偔敪擬偟偰梟偗崬傓丅乯丂僫僩儕僂儉傾儅儖僈儉傪悈偵擖傟傞偲丄悈慺傪敪惗偟偰悈巁壔僫僩儕僂儉偑悈拞偵曻弌偝傟傞丅偙傟偼丄乭悈嬧朄乭偲偟偰丄壵惈僜乕僟傪岺嬈揑偵惢憿偡傞曽朄偺堦偮偩偭偨丅
丂丂帋栻偲偟偰偺僫僩儕僂儉偼丄巁壔傪杊巭偡傞偨傔愇桘拞偵捑傔偰曐懚偝傟偰偄傞丅悈偲寖偟偔斀墳偡傞偺偱丄愨懳揑偵嬛悈偱偁傝丄庢傝埖偄偵偼姡偄偨僺儞僙僢僩側偳傪梡偄丄寛偟偰慺庤偱怗偭偰偼偄偗側偄丅徚壩偼姡憞偟偨嵒傪偐偗偰峴側偆丅丂悈偵搳擖偡傞幚尡傪偡傞偲偒偼丄彫摛戝掱搙偵偟丄寛偟偰戝偒偔愗偭偰偼側傜側偄丅 傑偨丄梋偭偨暘偼偡傒傗偐偵價儞偵栠偟丄彫曅傗婍嬶偵晅拝偟偨僫僩儕僂儉偺張棟偼丄傾儖僐乕儖偵捫偗偰傾儖僐儔乕僩偲偟偰埨慡偵張棟偡傞丅
丂丂揝嶮偺忋偱擱從偝偣傞偲丄夁巁壔僫僩儕僂儉乮俶倎2俷2乯偑惗偠傞丅 夁巁壔僫僩儕僂儉偼丄悈拞偱暘夝偟偰夁巁壔悈慺偑惗偠傞偺偱丄昚敀嵻偲偟偰梡偄傜傟傞丅乮挻巁壔僫僩儕僂儉乮俶倎2俷4乯偼俆侽侽亷俁侽侽婥埑埲忋偱惗惉偡傞丅傑偨丄僫僩儕僂儉扨懱偼200枩婥埑偺挻崅埑壓偱偼丄嵟奜妅揹巕偑墴偟崬傔傜傟 嬥懏岝戲傪幐偄摟柧偵側傞丅乯
丂丂僫僩儕僂儉偺墛怓斀墳偼丄俶倎 俢慄乮D1: 589.6値倣丄D2: 589.0値倣乯偺嫮偄墿怓偱偁傝丄僩儞僱儖側偳偺僫僩儕僂儉摂乮墿怓傪傛偔姶抦偡傞帇妎忋偺摿惈丄柖傗攣恛側偳偑懡偄嬻婥拞偺摟帇惈岦忋乯偵梡偄傜傟傞丅帴応拞偱僗儁僋僩儖偑暘楐偡傞乭僛乕儅儞岠壥乭偼偙偺俶倎 俢慄傪梡偄偰敪尒偝傟偨丅

丂丂嘇丂扽巁悈慺僫僩儕僂儉乮廳憘乯偺嶌惢丗丂扽巁悈慺僫僩儕僂儉乮廳憘丄俶倎俫俠俷3乯偼丄悈巁壔僫僩儕僂儉乮壵惈僜乕僟乯偲嫟偵丄僜乕僟岺嬈乮僈儔僗丄愇尣丄愻嵻揧壛嵻丄怘昳丄堛栻昳丄徚壩嵻丄偦偺懠傾儖僇儕傪昁梫偲偡傞嶻嬈乯偺婎杮揑側惢昳偺堦偮偱偁傞丅
丂丂愄偼丄怘墫偵棸巁傪壛偊壛擬偟偰墫巁傪惢憿偟偨屻偺巆熢偺棸巁僫僩儕僂儉傪尨椏偲偟丄偙傟偵僐乕僋僗丄愇奃愇傪崿偤嫮擬偟偰丄棸壔僫僩儕僂儉傪宱偰扽巁僫僩儕僂儉傪娷傓奃乮僽儔僢僋傾僢僔儏乯偲偟丄悈偱怹弌偟偰嶌傜傟偰偄偨丅偐側傝偺枹斀墳偺棸壔僫僩儕僂儉傪娷傫偱偄傞偑丄扽巁僫僩儕僂儉偺廫悈墫乮愻戵僜乕僟乯偵寢徎壔偝偣傞偙偲偵傛傝惛惢偟偨丅乮儖僽儔儞朄乯
丂丂尰嵼偼丄朞榓怘墫悈偵傾儞儌僯傾傪朞榓偝偣偨塼乮傾儞儌僯傾偐傫悈乯偵扽巁僈僗傪悂偒崬傫偱惢憿偝傟傞乮僜儖償僃乕朄丄E.Solvay丄1866乯丅扽巁僈僗偼愇奃楩偐傜嫙媼偝傟丄弌棃偨愇奃偼傾儞儌僯傾偺嵞惗偵梡偄傜傟傞丅丂傑偨丄壵惈僜乕僟梟塼偵扽巁僈僗傪悂偒崬傫偱傕嶌傞偙偲偑偱偒傞丅墫壔價僯儖側偳偺墫慺偺廀梫偑懡偄尰嵼偱偼偙偪傜偺傎偆偑庡棳偲側偭偰偄傞丅
丂丂傑偨丄傾儊儕僇丒儚僀僆儈儞僌廈偺僩儘僫峼愇傪偼偠傔丄働僯傾丄僄僕僾僩側偳偺乭揤慠僜乕僟乭偺朙晉側帒尮偑敪尒偝傟丄僜儖償僃乕朄偵傛傞惗嶻偼彮側偔側偭偰偄傞丅
丂丂扽巁悈慺僫僩儕僂儉偼丄扽巁僫僩儕僂儉乮扽巁僜乕僟乯偺巁惈墫偱偁傝丄俇侽亷埲忋乮幚嵺偼400-500亷乯偵壛擬偡傞偲扽巁僈僗傪敪偟偰暘夝偟偼偠傔 扽巁僫僩儕僂儉偵側傞丅
丂丂丂丂丂丂丂丂俀俶倎俫俠俷3丂仺丂俶倎2俠俷3丂亄丂俠俷2丂亄丂俫2俷
丂丂扽巁僫僩儕僂儉乮俶倎2俠俷3乯偺侾侽亾掱搙偺悈梟塼偵徚愇奃乮俠倎乮俷俫乯2乯傪壛偊 傛偔潣漚偡傞偲丄悈巁壔僫僩儕僂儉乮壵惈僜乕僟丄俶倎俷俫乯偑偱偒傞偺偱丄偦偺忋悷傒傪孹幬偟偰庢傞丅偙偺応崌偺壵惈壔棪偼俋侽亾偔傜偄偱丄梟塼偑敄偄傎偳斀墳偑塃偵恑峴偡傞丅乮仏丂捠忢丄壵惈僜乕僟偼丄怘墫悈偺 妘枌傪夘偟偨揹夝偵傛偭偰惢憿偝傟傞丅乮妘枌朄乯乯
丂丂丂丂丂丂丂丂丂俶倎2俠俷3丂亄丂俠倎乮俷俫乯2丂仺丂俀俶倎俷俫丂亄丂俠倎俠俷3
丂丂丒丂僜儖償僃乕朄乮傾儞儌僯傾僜乕僟朄乯偺幚尡丗丂朞榓怘墫悈栺俆侽倣倢傪侾侽侽們們嶰妏僼儔僗僐偵庢傝丄擹傾儞儌僯傾悈乮俀俉亾乯栺俆侽倣倢傪擖傟偨俁侽侽倣倢暯掙僼儔僗僐傪壐傗偐偵壛擬偟丄敪惗偟偨傾儞儌僯傾傪嶰妏僼儔僗僐偵摫偒丄傛偔怳傝崿偤媧廂偝偣偰傾儞儌僯傾偐傫悈傪嶌傞丅乮拲丗 屗奜偱峴側偆乯丂堦晹丄怘墫偑捑揳偡傞偺偱丄偦偺忋悷傒傪庢傞丅
丂丂乮仏丂扽巁悈慺僫僩儕僂儉偼丄捑揳偲偟偰梟塼偺宯奜偵弌傞偙偲偵傛偭偰丄斀墳偑塃偵恑峴偡傞丅偟偨偑偭偰丄扨偵擹傾儞儌僯傾悈傪朞榓怘墫悈偵崿崌偟偰扽巁僈僗傪捠偠傞偩偗偱偼丄朞榓偵払偣偢捑揳偟側偄丅 傑偨丄朞榓怘墫悈偵丄屌宍偺扽巁傾儞儌僯僂儉乮幚嵺偼丄扽巁悈慺傾儞儌僯僂儉乯傪壛偊丄傛偔潣漚偡傞偙偲偵傛偭偰傕偱偒傞丅乯
丂丂師偵丄扽巁僈僗敪惗婍偐傜丄扽巁僈僗傪傾儞儌僯傾偐傫悈偵摫偔丅偟偽傜偔扽巁僈僗傪捠偠偰偄傞偲丄偁傞帪偐傜媫偵敀戺偟偰扽巁悈慺僫僩儕僂儉偑捑揳偟偰偔傞丅乮拲丗 摫捠偡傞扽巁僈僗偺検偼寢峔昁梫偱丄崱夞巊偭偨俀侽侽們們偺扽巁僈僗敪惗婍偼丄侾乣俀夞拞枴傪庢傝懼偊側偗傟偽側傜側偐偭偨丅扽巁僈僗儃儞儀偑偁傟偽偦傟偵墇偟偨偙偲偼側偄丅乯
丂丂丂丂丂丂丂俶倎俠倢丂亄丂俶俫3丂亄丂俠俷2丂亄丂俫2俷丂仺丂俶倎俫俠俷3 伀丂亄丂俶俫4俠倢

丂丂乮俀乯丂僇儕僂儉偲偦偺壔崌暔丗
丂丂嘆丂嬥懏僇儕僂儉偺幚尡丗 婋尟丒庢傝埖偄梫拲堄両丂丂僇儕僂儉乮塸岅偱偼Potassium丄梈揰丗63丏7亷丄斾廳丗侽丏俉俇丄揹婥堿惈搙侽丏俉俀丄僋儔乕僋悢俀丏係亾乯傕僫僩儕僂儉摨條庢傝埖偄偵偼拲堄傪梫偡傞丅僇儕僂儉偼丄僫僩儕僂儉傛傝傕廮傜偐偄嬥懏偱丄偝傜偵寖偟偔悈傗巁慺偲斀墳偡傞丅悈偵搳擖偟偨応崌偼丄愒巼怓偺墛傪忋偘偰寖偟偔擱偊傞丅丂傑偨丄僇儕僂儉偼嬻婥拞偱寖偟偔擱從偟丄墿怓偺夁巁壔僇儕僂儉乮俲2俷2乯丄烌墿怓偺挻巁壔僇儕僂儉乮俲2俷4乯傪惗偠傞丅挻巁壔僇儕僂儉偼扽巁僈僗傪媧偭偰巁慺傪曻弌偡傞偺偱丄巁慺儅僗僋傗丄愽悈娡丒塅拡慏側偳偺巁慺尮偲偟偰梡偄傜傟傞丅丂傑偨丄僫僩儕僂儉偲偺崌嬥乮俶倎俲乯偼梈揰偑掅偄偺偱尨巕楩偺侾師椻媝嵽偵梡偄傜傟傞丅
丂丂僇儕僂儉偼丄僇儕挿愇側偳偲偟偰峀偔抧妅偵娷傑傟偰偄傞偑丄僇儕僂儉帒尮偲偟偰偼偡傋偰墫壔僇儕僂儉偺宍乮僇乕僫儕僢僩乮KCl丒MgCl2丒6H20乯側偳乯偱嵦庢偝傟丄俋俆亾偑旍椏梡偵丄俆亾偑扽巁僇儕僂儉側偳偺壔惉昳惢憿偵梡偄傜傟傞丅
丂

丂丂嘇丂栘奃偐傜扽巁僇儕僂儉丄徤巁僇儕僂儉偺嶌惢丗丂栘奃偵偼丄俆乣侾侽亾掱搙偺扽巁僇儕僂儉偑娷傑傟偰偄傞丅乮仏 栘嵽侾倠倗偐傜俀俆倗偟偐栘奃偑庢傟側偄丅 傑偨丄悈愻偝傟偰丄僇儕僂儉暘偑敳偗偰偟傑偭偨傕偺傕斕攧偝傟偰偄傞偺偱拲堄乯
丂丂栘奃傪悈偵梟偄偰乭奃廯乮偼偄偠傞丄偁偔偠傞乯乭傪嶌傝丄偙傟傪鄅夁偟偰幭媗傔傞偲丄慹惢扽巁僇儕僂儉乮俲2俠俷3乯偑偱偒傞丅偝傜偵丄偙傟偵傗傗夁忚偺徤巁傪壛偊偰拞榓偟丄擹弅偟偰曻椻偡傞偲 妱崌弮悎側徤巁僇儕僂儉乮徤愇丄俲俶俷3乯偺寢徎偑愅弌偟偰偔傞丅
丂丂扽巁僇儕僂儉偼丄傾儖僇儕惈側偺偱揱摑揑側愼怓偵梡偄傜傟傞丅傑偨桘帀傪尣壔偡傞摥偒偑偁傝丄揤慠僜乕僟偲嫟偵丄愄偐傜愻戵偵梡偄傜傟偨丅乮僇儕僂儉偺塸岅柤丒億僞僔僂儉Pot-assi-um偼丄乭奃偺捹乭偐傜棃偨柦柤乯丂傑偨丄徤巁僇儕僂儉偼崟怓壩栻傗壴壩丄旍椏偵梡偄傜傟傞丅
丂丂仏丂徤愇偼丄嬻拞拏慺屌掕朄偵傛傞徤巁惢憿偑峴側傢傟傞埲慜偼丄摦暔偺巰奫傗暢擜傪僇儕僂儉傪娷傓搚偲崿崌偟丄垷徤巁嬠偲徤巁嬠偺嶌梡偵傛傝丄塉偑偐偐傜側偄傛偆偵偟偰挿偄擭寧曻抲偟偰惢憿偝傟偨丅乮徤愇墍朄乯丂傑偨偦偺屻偼丄僠儕徤愇乮俶倎俶俷3乯偵墫壔僇儕僂儉傪壛偊 暋暘夝偟偰惢憿偝傟偰偒偨楌巎偑偁傞丅乮尰嵼 僠儕徤愇偼丄僌儕乕儞儔儞僪偺昘徎愇偲摨條偵丄傎傏帒尮屚妷偟偨丅乯

丂丂乮俁乯丂儕僠僂儉丒懠偺傾儖僇儕嬥懏丗
丂丂嘆丂儕僠僂儉偺幚尡丗丂儕僠僂儉乮俴倝丄尨巕斣崋俁丄梈揰丗侾俉侽丏俆亷丄斾廳丗侽丏俆俁俆丄揹婥堿惈搙侽丏俋俉丄僋儔乕僋悢侽丏侽侽俇亾丄巁壔娨尦揹埵丗亅俁丏侽係侽倁乮慡尦慺拞 嵟傕掅偄乯丄墛怓斀墳丗愒乯偼丄帺慠奅偵峀偔暘晍偟丄怉暔乮摿偵僞僶僐丄拑乯偵擹弅偟偰偄傞丅丂嬥懏儕僠僂儉偼柍悈墫壔暔偺梟梈揹夝偵傛偭偰惢憿偝傟傞丅
丂丂嬥懏儕僠僂儉偼丄僫僩儕僂儉傗僇儕僂儉側偳傛傝傕壐傗偐偵悈傗巁慺偲斀墳偟丄儕僠僂儉偲偦偺墫偺壔妛揑惈幙偼傾儖僇儕搚椶嬥懏乮俵倗丄俠倎丄俛倎側偳乯偵嬤偄丅儕僠僂儉偺彫曅傪悈偵搳擖偡傞偲丄敪壩傕梟梈傕偣偢偵悈慺傪敪偟偰悈偺忋傪摦偒夞傞丅儕僠僂儉傪壛擬偡傞偲傛偔擱偊傞丅乮 拲堄乯 僈儔僗偺帋尡娗偵嬥懏儕僠僂儉傪擖傟偰壛擬偡傞偲丄僈儔僗偲斀墳偟偰寖偟偔擱從偟丄帋尡娗傪攋懝偡傞丅乯
丂丂儕僠僂儉偼丄尨巕検偑彫偝偔寉検偱丄巁壔娨尦揹埵偑嵟傕掅偄偺偱丄揹抮偲偟偰偺梡搑偑戝偒偄丅揹婥帺摦幵傗揹婥婡婍側偳偺揹抮乮堦師丗儕僠僂儉揹抮丄擇師丗儕僠僂儉僀僆儞揹抮乯梡偵懡検偵梡偄傜傟丄偦偺懠丄崌嬥丄桳婡儕僠僂儉壔崌暔偺惢憿丄寢徎壔僈儔僗傗缰偺惉暘丄堛栻昳側偳偵梡偄傜傟傞丅丂儕僠僂儉偼抧妅偵峀偔暘晍偟偰偄偰丄岺嬈揑偵嵦嶼偑崌偆峼嶳帒尮乮墫屛偐傫悈傗峼愇側偳乯偺杽憼検傕丄彨棃偺屚妷偺怱攝偑柍偄傎偳廩暘偵偁傞丅偟偐偟丄儗傾儊僞儖暲傒偵悽奅偵偒傢傔偰曃嵼偟丄惌帯揑側栤戣傕偁傞偺偱丄偦偺嵟戝徚旓崙偱偁傞擔杮乮2008擭丄弮儕僠僂儉姺嶼暘偺桝擖丗13194倲乯偼帒尮妉摼偺偨傔偵愊嬌揑偵摥偒偐偗偰偄傞丅乮撿暷儃儕價傾丒杽憼検侾埵乯丂奀悈偐傜偺嵦庢媄弍傕丄崙撪偱杮奿揑偵尋媶偑恑傔傜傟偰偄傞丅
丂丂丒丂墫壔儕僠僂儉偺擹梟塼偵丄拞惈乣傾儖僇儕惈偱 擹偄扽巁僇儕僂儉梟塼傪壛偊傞偲丄梟夝搙偺掅偄扽巁儕僠僂儉乮俴倝俠俷3丄侾丏俁俁倗/侾侽侽倣倢悈乯偑備偭偔傝偲捑揳偡傞丅偙偺斀墳偼丄峼愇偐傜儕僠僂儉傪暘棧偡傞偲偒偵梡偄傜傟傞丅
丂丂丂丂丂丂丂丂丂丂丂丂丂丂俀 俴倝俠倢丂亄丂俲2俠俷3丂仺丂俴倝2俠俷3 伀丂亄丂俀 俲俠倢

丂丂嘇丂扽巁僙僔僂儉偺幚尡丗丂懠偺傾儖僇儕嬥懏偲偟偰丄儖價僕僂儉乮俼倐丄尨巕斣崋俁俈丄梈揰丗俁俋丏俁亷丄斾廳丗侾丏俆俁丄揹婥堿惈搙侽丏俉俀丄僋儔乕僋悢侽丏侽俁亾丄墛怓斀墳丗愒乯丄僙僔僂儉乮俠倱丄尨巕斣崋俆俆丄梈揰丗俀俉丏係亷丄斾廳丗侾丏俉俉丄揹婥堿惈搙侽丏俈俋丄僋儔乕僋悢侽丏侽侽侽俈亾丄墛怓斀墳丗惵巼乯偑偁傞丅乮僼儔儞僔僂儉乮俥倰丄尨巕斣崋俉俈乯偼敿尭婜偑旕忢偵抁偄曻幩惈尦慺乯
丂丂儖價僕僂儉偼丄乮僙僔僂儉傕偦偆偱偁傞偑丄乯掅擹搙側偑傜帺慠奅偵峀偔暘晍偟丄摿偵丄怉暔偵僇儕僂儉偲嫟偵媧廂偝傟傗偡偔怉暔懱偵偐側傝娷傑傟傞丅姡憞帋椏傪婓墫巁偱怳偲偆偟偰拪弌偝傟丄尨巕媧岝朄乮780nm丒愒奜偵嬤偄愒乯偱儖價僕僂儉偑梕堈偵暘愅偱偒傞丅傑偨丄帺慠奅偵俀俈丏俉亾懚嵼偡傞 87俼倐偼丄87俼倐 仺 87俽倰丂偺傛偆偵兝-曵夡乮敿尭婜係俈侽壄擭乯偡傞丅偙傟偼丄40俲丄238倀 偲暲傫偱丄敿尭婜偑挿偡偓傞偨傔 慡偔巊梡偵揔偝側偄偵傕偐偐傢傜偢丄娾愇偺擭戙應掕偵柍棟傗傝梡偄傜傟丄恑壔榑傪巟帩偡傞徹嫆偲偟偰悂挳偝傟偰偒偨丅
丂丂僙僔僂儉133乮帺慠奅侾侽侽亾丒旕曻幩惈乯偼僙僔僂儉尨巕帪寁偵梡偄傜傟傞丅乮崙嵺扨埵宯偺乭昩乭偑偙偺僙僔僂儉尨巕帪寁偵傛偭偰掕媊偝傟偰偄傞丅僙僔僂儉忲婥偺偆偪婎掙忬懺偺傕偺偵儅僀僋儘攇傪摉偰丄僗儁僋僩儖偺媧廂慄偺検偐傜惓妋側廃攇悢偺儅僀僋儘攇傪寛掕偡傞丅10-11乮3000擭偵1昩乯偐傜10-15乮3000枩擭偵1昩乯掱搙偺岆嵎丅乯
丂丂扽巁僙僔僂儉乮俠倱2俠俷3乯偼丄溟巁僙僔僂儉傪壛擬暘夝偟偰嶌傜傟傞丅偙傟偼挭夝惈偺屌懱偱丄悈偵旕忢偵傛偔梟偗傞丅乮俀俇侽倗/侾侽侽倣倢悈乯丂墫壔僙僔僂儉傕梟夝搙偑戝偒偄乮侾俇俀倗/侾侽侽倣倢悈乯丅
丂丂墫壔僙僔僂儉乮俠倱俠倢乯偼丄摫揹惈僈儔僗偺惢憿偵梡偄傜傟傞丅惗壔妛暘栰偱偼丄暘巕検乮幃検乯偑旕忢偵戝偒偄俢俶俙偺墦怱暘棧傪峴側偆嵺偵丄俠倱俠倢偺暘巕検偑戝偒偄偙偲傪棙梡偟偰丄捑崀懍搙偑僽儔僂儞塣摦偲掁傝崌偆乭捑崀暯峵乭偺憌傪嶌傝弌偟丄俢俶俙偺暘巕検偵墳偠偰僐儞僩儘乕儖偡傞偨傔偵峀偔梡偄傜傟偰偄傞丅乮晛捠偺嵶朎慻怐傗偨傫傁偔幙偱偼 僔儑摐偑梡偄傜傟傞丅乯
丂丂僙僔僂儉偺墛怓斀墳偼丄敄偄惵巼怓丅
丂丂丂